Cell子刊:张弩团队开发circRNA疫苗,编码lncRNA来源蛋白,治疗脑肿瘤
来源:生物世界 2024-11-06 09:48
中山大学第一附属医院张弩、刘雪松、张茂雷等研究发现长链非编码RNA-H19(Lnc-H19)编码一种免疫相关蛋白——H19-IRP。
中山大学第一附属医院张弩、刘雪松、张茂雷等人在 Cell 子刊 Cell Reports Medicine 上发表了题为Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma 的研究论文。
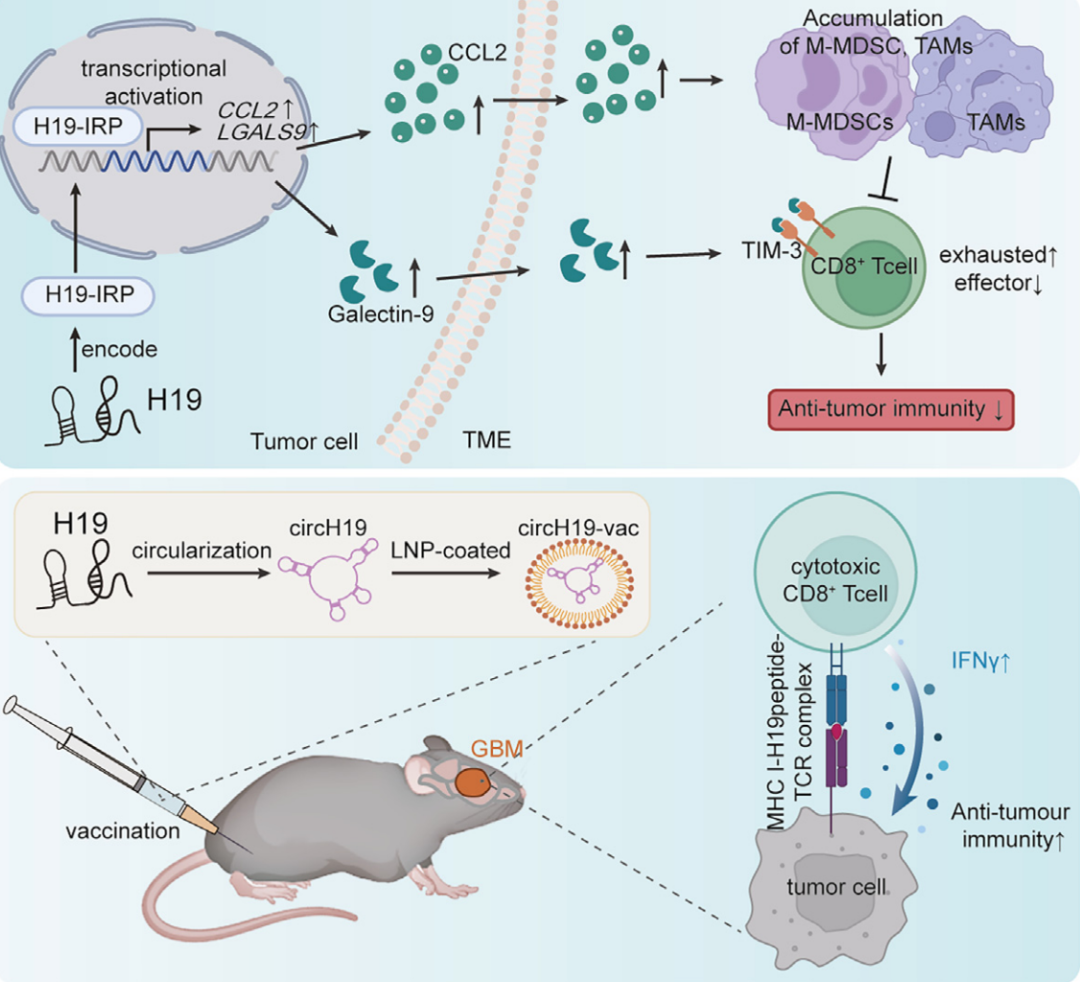
该研究发现长链非编码RNA-H19(Lnc-H19)编码一种免疫相关蛋白——H19-IRP。该蛋白独立于Lnc-H19发挥作用——促进胶质母细胞瘤(GBM)的免疫抑制,招募髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM),导致T细胞耗竭和免疫抑制性GBM-TME。
H19-IRP在临床GBM样本中过表达,可作为肿瘤相关抗原(TAA)。研究团队将Lnc-H19环化为环状RNA疫苗——circH19-vac,其可触发针对GBM的强效细胞毒性T细胞应答,并抑制体内的GBM生长。该研究强调了H19-IRP通过招募MDSC和TAM来产生免疫抑制性GBM-TME的功能,支持了以H19-IRP为靶点的癌症疫苗用于GBM治疗的想法。

肿瘤微环境(TME)的多种细胞群,包括肿瘤相关巨噬细胞(TAM)、髓源性抑制细胞(MDSC)、中性粒细胞、树突状细胞(DC)和自然杀伤细胞,与免疫抑制的调节和促进脑肿瘤进展有关。例如,在GBM中,骨髓来源的巨噬细胞倾向于表现出免疫抑制表型,从而促进肿瘤进展。GBM的单细胞RNA测序(scRNA-seq)图谱也显示肿瘤的进展与免疫抑制细胞(例如TAM和MDSC)的浸润相一致。具有免疫抑制作用的TME也会影响疗效。TME中缺乏细胞毒性T细胞、记忆性T细胞、TH1细胞和其他淋巴细胞浸润,往往导致免疫治疗效果不佳。基于这些发现,近年来的研究尝试将“冷” TME转变为“热” TME作为治疗策略。然而,这些策略仍处于临床前阶段,临床获益不确定。因此,迫切需要寻找更有效的靶点来改善或逆转免疫抑制性的GBM-TME。
长链非编码RNA (lncRNA)是一类长度超过200nt的非编码基因,已被证明参与许多生理和病理过程,包括免疫相关功能,例如髓系细胞极化、T细胞活化和抗原呈递。Lnc-H19(简称H19),是最早被鉴定的lncRNA之一,并被认为在多种恶性肿瘤中发挥癌基因的作用,包括胶质母细胞瘤(GBM)。
H19通过竞争性内源RNA(ceRNA)机制与mRNA相互作用来发挥作用,从而调节对肿瘤进展至关重要的基因的表达。此外,H19还能激活关键信号通路,促进细胞存活。这一多方面的功能强调了H19对癌症生物学贡献的复杂性。
值得注意的是,近年来翻译组学的研究进展支持某些lncRNA实际上具有编码功能性蛋白/多肽的能力,丰富了lncRNA的功能谱。例如,肿瘤中差异表达的lncRNA编码的蛋白可以作为肿瘤相关抗原(TAA)或肿瘤特异性抗原(TSA)激活特异性T细胞应答。由于其在肿瘤中的重要功能和表达模式,这些未被揭示的lncRNA编码蛋白可能是介导免疫抑制性的GBM-TME的重要因素,并有望成为GBM有前景的治疗靶点。
癌症疫苗因其独特的优势(例如能够靶向细胞内和细胞外抗原,激发抗原特异性免疫应答)而越来越受到关注。与线性的mRNA疫苗相比,环状RNA疫苗因其闭合环状结构和较长的半衰期而具有高度的稳定性,有利于稳定表达。
环状RNA疫苗已被证明能有效刺激不同疾病的免疫应答。尽管环状RNA疫苗具有很好的应用前景,但针对GBM的有效抗原靶点仍有待探索。
在这项最新研究中,研究团队发现,Lnc-H19能够编码蛋白质——H19-IRP。H19-IRP蛋白(而不是Lnc-H19本身)通过直接激活CCL2和Galectin-9的转录,促进MDSC/TAM的浸润和T细胞耗竭,在免疫抑制性的胶质母细胞瘤肿瘤微环境(GBM-TME)的形成中发挥关键作用。
H19-IRP在GBM细胞中高度特异性表达,使其可作为肿瘤相关抗原(TAA),将Lnc-H19环化,构建出环状RNA疫苗——circH19-vac,其通过表达H19-IRP,刺激有效的T细胞抗肿瘤反应,抑制体内的GBM进展。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


